

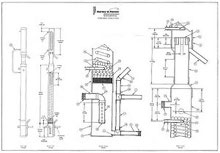
 Construcción y uso de un alambique para etanol
Construcción y uso de un alambique para etanol© Copyright 1980 J.A. Diaz Publications
Autor: S.W. Mathewson
Las propiedades del alcohol y la gasolina son muy parecidas, aunque sean muy distintos químicamente. La gasolina es una mezcla de hidrocarburos, es decir, de compuestos formados por átomos de carbono e hidrógeno. Hay muchos miles de hidrocarburos distintos. La mayoría de los combustibles, como el carbón, la gasolina, el queroseno, el butano, el propano... son hidrocarburos. El más simple de ellos es el metano, que consiste en un átomo de carbono unido a cuatro átomos de hidrógeno. El siguiente es el etano, con dos átomos de carbono y seis de hidrógeno. El propano tiene tres átomos de carbono y el butano tiene cuatro. Todos ellos son gases en condiciones normales. Al alargar la cadena con más átomos de carbono los compuestos se vuelven líquidos: pentano, hexano, heptano, octano... Cuanto más larga sea la cadena más espeso es el líquido, hasta llegar a los hidrocarburos sólidos.
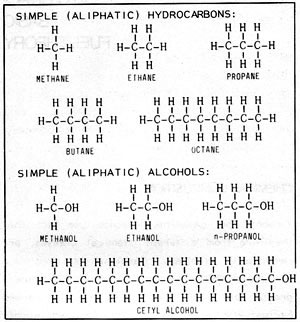
Los alcoholes se pueden considerar como hidrocarburos en los que un átomo de hidrógeno ha sido reemplazado por un grupo hidroxilo, formado por un átomo de hidrógeno unido a un átomo de oxígeno. Así, el metano se convierte en alcohol metílico, o metanol; el etano en alcohol etílico, o etanol; el propano en alcohol propílico. También hay muchos alcoholes distintos.
Una de las propiedades más importantes de cualquier combustible es la cantidad de energía que se consigue al quemarlo. Como muestra la figura 2-2, el octano (un hidrocarburo), que se puede considerar una «gasolina ideal», no contiene oxígeno. Todos los alcoholes contienen un átomo de oxígeno unido a otro de hidrógeno en el grupo hidroxilo. Cuando arde el alcohol, el grupo hidroxilo se combina con un átomo de hidrógeno para formar una molécula de agua. Por lo tanto el átomo de oxígeno no contribuye al poder calorífico del combustible.
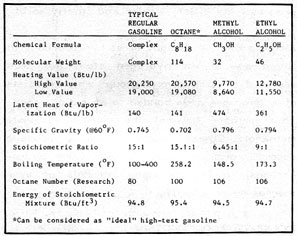
Las masas atómicas relativas de los átomos presentes son: hidrógeno, 1; carbono, 12; oxígeno, 16. La masa molecular del alcohol metílico es 32. La mitad de la molécula no se puede «quemar», y no contribuye al poder calorífico. Como es de esperar el poder calorífico del metanol es la mitad que el de la gasolina. El etanol, con un 35% de oxígeno, es un poco mejor, con un 60% del poder calorífico de la gasolina.
Si se considera únicamente el poder calorífico de estos dos alcoholes, el metílico y el etílico, pueden parecer malos combustibles para motor. Sin embargo en algunos aspectos, como el calor latente de vaporización y la capacidad antidetonante, son mejores que la gasolina.
Para que un combustible arda bien hay que mezclarlo con cierta cantidad de aire. Cuando las cantidades de combustible y aire están equilibradas se dice que la mezcla es estequiométricamente correcta. La relación estequiométrica de la gasolina es 15:1, o quince unidades de aire por cada unidad de gasolina. La proporción para el alcohol metílico es 6,45:1, y para el etílico 9:1. En la práctica, para que el alcohol arda bien hay que cambiar o ajustar los inyectores de combustible del carburador para que mezclen 2,3 partes de metanol por cada quince partes de aire, ó 1,66 partes de etanol por cada quince partes de aire.
Haciendo mezclas estequimétricas correctas la energía contenida en cada pie cúbico de las tres mezclas aire/combustible es casi la misma. Para la gasolina es de 94,8 BTU/pie3, para el metanol 94,5 BTU/pie3, y para el etanol 94,7 BTU/pie3. La gasolina y el alcohol tienen casi la misma eficiencia volumétrica si se queman en un motor bien ajustado.
Otra propiedad importante de los combustibles para motor es la volatilidad, o facilidad para evaporarse. Como se indicó antes, el poder calorífico del metanol es menos de la mitad del de la gasolina, y el del etanol es aproximadamente el 60% del de la gasolina. El siguiente alcohol más complejo, el propílico (con tres átomos de carbono) tiene solamente un 26,6% de oxígeno y por lo tanto un 74% del poder calorífico de la gasolina. Resulta evidente que cuanto más complejo es un alcohol más próximo está su poder calorífico al de la gasolina. El alcohol cetílico (figura 2-1), por ejemplo, contiene solamente un 6,6% de oxígeno, y su poder calorífico es el 90% del de la gasolina. Sin embargo este alcohol es una pasta sólida. No se puede evaporar ni mezclar con aire dentro de un motor; no sirve como combustible para motores. Al elegir un alcohol como combustible hay que buscar un equilibrio entre poder calorífico y volatilidad.
El calor latente de vaporización es una cualidad estrechamente relacionada con la volatilidad. Cuando un líquido alcanza su punto de ebullición hay que aplicarle una cierta cantidad de calor para que se evapore. Esa cantidad de calor es lo que se llama calor latente de vaporización. Es uno de los principios en los que se basa la refrigeración, y la razón de que la evaporación de agua sobre la piel haga sentir frescor.
La gasolina tiene un calor latente de vaporización de 140 Btu/lb; el metanol de 474 Btu/lb; el etanol de 361 Btu/lb. En un motor la evaporación de la gasolina causa un enfriamiento de 40º F. En condiciones similares el enfriamiento causado por la evaporación de alcohol etílico es más del doble que con la gasolina, y para el metanol es el triple. Este enfriamiento resulta en una densidad de masa considerablemente mayor en el alcohol respecto a la gasolina. Por ello los alcoholes son unos combustibles mucho más eficientes que la gasolina. Para entender por qué recuerda que a presión constante el volumen ocupado por un gas es directamente porporcional a su temperatura. Por ejemplo, si en un recipiente cabe un quilogramo de un gas, con una presión determinada, si la temperatura se redujera a la mitad en ese recipiente cabrían dos quilogramos del gas. En un motor la mezcla estequiométrica de metanol y aire se enfriaría el triple que la mezcla de gasolina y aire. En el cilindro entra el triple (por masa) de metanol. Aunque el metanol tenga la mitad de poder calorífico que la gasolina, la ganancia neta de eficiencia masa-volumen es el triple. Por ejemplo, si la mezcla de aire y gasolina dentro de un cilindro produce 100 Btu en cada explosión, con metanol en el mismo cilindro se producirían 150 Btu. Esta ganancia de potencia debida al aumento de la eficiencia masa-volumen es el principal motivo de la popularidad del metanol como combustible para carreras. Este efecto no es tan pronunciado con el etanol, pero su mayor poder calórico compensa parcialmente su menor calor latente de vaporización. En conjunto, la mayor potencia de los alcoholes compensa su menor poder calórico.
Sin embargo el enfriamiento debido al calor latente de vaporización a veces da problemas en los motores. Una vez evaporado es necesaria una determinada cantidad de calor para evitar que vuelva a licuarse antes de llegar al cilindro. Para evitarlo se diseñan los motores de forma que el colector de admisión esté lo bastante caliente. El alcohol, por su mayor calor latente, requiere más temperatura que la gasolina. Este es el motivo de que los motores de carreras tengan colectores de admisión cortos y varios carburadores. Cuanta menos distancia tenga que recorrer el combustible hasta el cilindro menos problemas habrá con la condensación y la distribución. En la práctica la mayoría de los motores que se adaptan para el alcohol mantienen una temperatura adecuada después de haberse calentado. El problema, como ocurre con los motores de carrereras, es el arranque en frío. Este problema y la distribución de combustible se tratan en detalle más adelante.
Si se quema un combustible en un motor con razón de compresión regulable, y se incrementa gradualmente, en algún momento la detonación se producirá prematuramente. Es así porque los gases desprenden calor cuando se comprimen. Si la mezcla de aire y combustible se comprime lo suficiente dentro de un cilindro, el calor que se desprende causará la detonación. Los motores de gasolina están diseñados para que la detonación sea causada por la bujía al principio del movimiento de descarga, después de la compresión. Una ignición prematura durante la compresión es perjudicial; incluso puede desgastar rápidamente el motor y averiarlo.
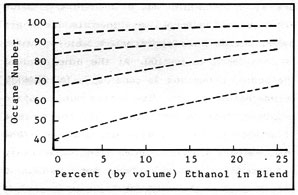
Con una mayor razón de compresión la potencia y la eficiencia también son mayores. En los combustibles es deseable la resistencia a la detonación prematura. El número de octanos asignado a los combustibles está basado en un hidrocarburo puro, el octano, al que se asigna un valor de cien. En el otro extremo de la escala está el n-heptano con un valor de cero. El número de octanos de un combustible está basado en el porcentaje de volumen de una mezcla de octano y n-heptano que coincide con sus características de preignición. En la práctica se hacen ensayos en un motor de prueba de compresión variable. Los alcoholes tienen un buen octanaje y mejoran considerablemente el octanaje de las gasolinas con las que se mezclan. El efecto es más acusado en las gasolinas de peor calidad. Una mezcla de 25% de etanol con gasolina de cuarenta octanos la mejora en casi treinta puntos. Esta mejora es una de las mayores ventajas de las mezclas. Las consecuencias de mejorar el octanaje son: se puede convertir una gasolina de pocos octanos (más barata) en un combustible con un octanaje determinado; se puede prescindir de aditivos antidetonantes tóxicos, como el tetraetilo de plomo. La incorporación de un 10-15% de etanol a la gasolina sin plomo mejora el octanaje lo suficiente para poder usarla en motores de gran compresión en los que normalmente no se podría usar.
Durante la Segunda Guerra Mundial se utilizó mucho la inyección de agua en los motores de pistón de gran rendimiento para la aviación militar. Después se utilizó en aviones civiles y militares para aumentar el empuje, principalmente durante el despegue. Hoy en día hay disponibles sistemas de inyección de agua para automóviles. Dichos sistemas aumentan la pontencia, con algunas limitaciones. El calor latente de vaporización de la gasolina es de 140 Btu/lb y el del etanol 361 Btu/lb. El calor latente de vaporización del agua es de 700 Btu/lb. Por tanto si se inyecta un poco de agua en el carburador rociada en gotitas minúsculas el calor latente de vaporización del agua enfría la mezcla e incrementa la eficiencia volumétrica. Además cuando la mezcla arde en el cilindro el agua se convierte en vapor y proporciona más potencia por la presión que ejerce. Sin embargo hay un límite para la cantidad de agua que se puede inyectar. Un exceso refrigera demasiado.
Para inyectar agua en un motor alimentado por gasolina hace falta un segundo sistema de medida e inyección, porque la gasolina y el agua no se mezclan. El etanol y el agua sí se mezclan; los beneficios de la inyección de agua se pueden conseguir poniendo la cantidad apropiada de agua en el depósito de combustible junto con el etanol.
En teoría cuando arde un hidrocarburo los únicos gases se forman son agua y dióxido de carbono (CO2). Este último no es tóxico, sale de nuestros pulmones al respirar, y está presente en las bebidas carbonatadas. Las plantas lo absorben mediante la fotosíntesis.
Sin embargo esa combustión ideal no se suele dar ni en los motores mejor ajustados. En los gases de escape hay mucho monóxido de carbono (CO), que es tóxico, y otros compuestos perjudiciales procedentes de impurezas como el azufre, y de aditivos como el plomo y el fósforo.
En teoría la combustión del alcohol puro en condiciones ideales produce únicamente dióxido de carbono y agua. En la práctica también produce algo de monóxido de carbono, pero mucho menos que la gasolina. El alcohol no contiene azufre ni aditivos, y no da lugar a compuestos tóxicos. La combustión del alcohol puro es muy limpia.
Se han realizado muchos estudios para determinar si mezclar alcohol con la gasolina tiene algún efecto positivo en las emisiones. En general muestran que no hay mucha diferencia si la cantidad de alcohol es menor del 20%. La reducción de las emisiones perjudiciales es proporcional a la proporción de alcohol en la mezcla. Por ejemplo en una mezcla con un 10% de alcohol, el 10% de las emisiones proceden de la combustión del alcohol, que arde más limpiamente.
El alcohol puro, como combustible no contaminante, cumpliría fácilmente todas las normas sobre emisiones sin complejos y cosotos convertidores catalíticos. La mayor ventaja de las mezclas con gasolina es que el alcohol reemplaza al plomo y otros aditivos antidetonantes problemáticos.
Ahora que hemos repasado los factores que influyen en el renrdimiento de los combustibles en el motor vamos a ver varias pruebas reales. La figura 2-4 es una gráfica en la que se compara el rendimiento con gasolina y con alcohol al 99%. En la gráfica la «presión efectiva media» es una medida directa de la potencia. La diferencia más significativa entre los dos combustibles es la mayor presión efectiva media del alcohol en todas las proporciones combustible/aire. La mayor presión efectiva media es debida a la gran eficiencia volumétrica del alcohol, causada por su mayor calor latente de vaporización y la mayor densidad de masa en la mezcla combustible/aire.
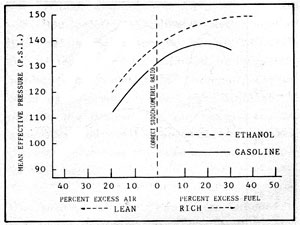
La presión efectiva media del etanol aumenta hasta el 40% de exceso de combustible, mientras que para la gasolina la máxima presión se da con un 20% de exceso de combustible. Podría parecer que para alcanzar la máxima potencia alimentando al motor con alcohol la mezcla debe ser muy rica en combustible. Las mezclas ricas en combustible para llegar a la máxima presión efectiva media van acompañadas de una combustión incompleta y la correspondiente pérdida de eficiencia térmica. El límite en la cantidad de aire para el alcohol y la gasolina, por lo tanto, es aproximadamene igual, y ambos combustibles llegan a la máxima eficiencia térmica con un 15% de exceso de aire. Si hay menos de un 15% de aire ambos combustibles pierden eficiencia térmica.
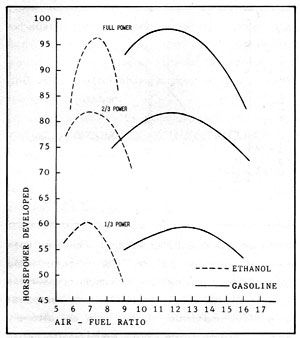
La figura 2-5 compara la potencia y la proporción aire/cvombustible para el etanol y la gasolina en un motor de seis cilindros. Los combustibles eran etanol al 95% y gasolina con una gravedad específica de 0,745. En las pruebas se introducía el aire por el colector de entrada a una temperatura constante de 100º F, y la válvula del carburador estaba ajustada para las proporciones aire/combustible elegidas. Se establecieron cargas de 2/3 y 1/3 ajustando el acelerador para que hubiera la misma presión de colector para ambos combustibles.
Son evidentes las menores proporciones aire/combustible del etanol respecto a la gasolina. En esta prueba, con el aire a la misma temperatura para los dos combustibles, la mezcla correcta de aire y combustible debería producir un 2% más de potencia con gasilina que con etanol. Sin embargo el alcohol, con su mayor calor latente de vaporización, requiere más calor en el colector para mantenerse gaseoso. En otra prueba donde se proporcionó este calor, la mezcla correcta de acohol/aire proporcionó 8,6% más de potencia que la gasolina. La prueba representada en la figura 2-5 se hizo con un alcohol que contenía un 5% de agua. Probablemente la presencia de agua mejoró los resultados del alcohol en cierta medida. Sin embargo lo importante es que los dos combustibles tienen un rendimiento similar en un motor bien ajustado.
Aunque las mezclas se pueden hacer con etanol o con metanol, el etanol es más interesante. El etanol se puede mezclar con gasolina en cualquier proporción, pero el metanol no. El etanol se puede producir con más facilidad a partir de fuentes renobables. En la mayoría de los casos el etanol es un poco mejor que el metanol como combustible para motor.
Dejando a un lado la economía, el etanol tiene la ventaja de que hasta cierta concentración (entre 10 y 20%) se puede usar sin ninguna modificación en el motor.
Los estudios sobre cómo afectan las mezclas al rendimiento son contradictorios. El reciente “Two Million Mile” de Nebraska concluye que el consumo de combustible es un poco menor que con gasolina. Otras pruebas dicen que es un poco mayor. Algunas pruebas dicen que las emisiones mejoran un poco, otras que no hay diferencia. En relación a la potencia son igualmente ambiguas. Sin embargo juntando todos los datos se llega a la conclusión de que en el consumo de combustible, las emisiones y el rendimiento no hay ninguna diferencia importante.
La figura 2-3, como se explica en Octanaje, ilustra otra de las ventajas de las mezclas con alcohol, que mejora la capacidad antidetonante de la gasolina. Esto significa que se pueden utilizar gasolinas más baratas y de peor calidad para obtener combustible con un octanaje determinado, sin necesidad de aditivos contaminantes. Es una mejora importante desde el punto de vista económico porque la producción de gasolina con muchos octanos es cara. Como se dijo antes, también es posible aumentar el octanaje de la gasolina sin plomo para usarla en motores donde normamente no se podría usar.
Las mezclas con alcohol tienen una pequeña desventaja. La presencia de agua en la mezcla, aunque sea en una cantidad muy pequeña, hace que se separen una parte del alcohol y la gasolina. A temperatura ambiente menos de un 1% de agua puede ser suficiente. Con más frío una cantidad tan pequeña como 0,01% puede causar la separación. Sin embargo se pueden añadir varias substancias para que la mezcla tolere mejor la presencia de agua, como el benceno y el alcohol butílico. En los sistemas de combustible cerrados se evita que aparezca humedad dentro del depósito de combustible. Las petroleras podrían, si recibieran incentivos, mantener libres de agua sus oleoductos e instalaciones de almacenamiento. El amplio uso de las mezclas con alcohol durante los últimos cincuenta años es una evidencia de que este problema tiene solución.
© El copyright de toda la información original de este sitio web es propiedad de Keith Addison, a no ser que se indique, y solamente puede ser copiada y distribuida con fines educativos no comerciales, si se indica la fuente y se incluye una referencia a la dirección web de Journey to Forever (http://journeytoforever.org/). Toda la información se suministra sin garantías de ninguna clase, ni implícitas ni explícitas.